国内干细胞新药研发速度明显加快, 2022年药物临床试验申请受理和默示许可数量实现双增长
来源:浙江思丹姆干细胞生物科技有限公司
发布时间:2023-09-21
转载自干细胞日记
随着《干细胞临床研究管理办法 (试行) 》和《干细胞制剂质量控制及临床前研究指导原则( 试行) 》以及《细胞治疗产品研究与评价技术指导原则(试行)》等政策出台,“放管服”规范监管使国内干细胞临床研究转化逐步走向正轨,并进一步明确了以干细胞药物作为转化出口的道路。目前,国内干细胞药物注册仍正处在蓬勃发展的趋势中。自从2018年国家药品监督管理局药品审评中心(CED)重新受理干细胞新药临床试验申报以来,干细胞药物临床试验的申请稳步增长。就承办受理号总量,从2018年申报5个增长至2022年的26个,较2021年度增长了一倍,我国干细胞新药研发速度明显加快。
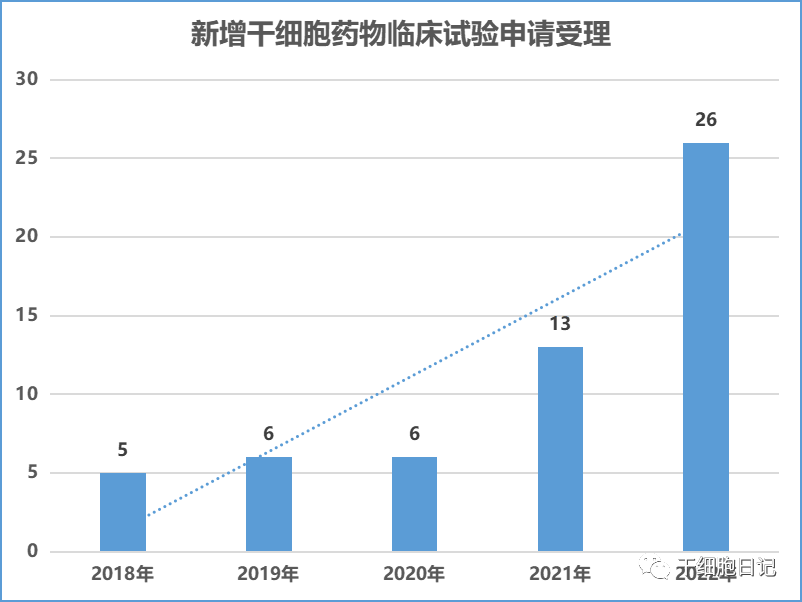
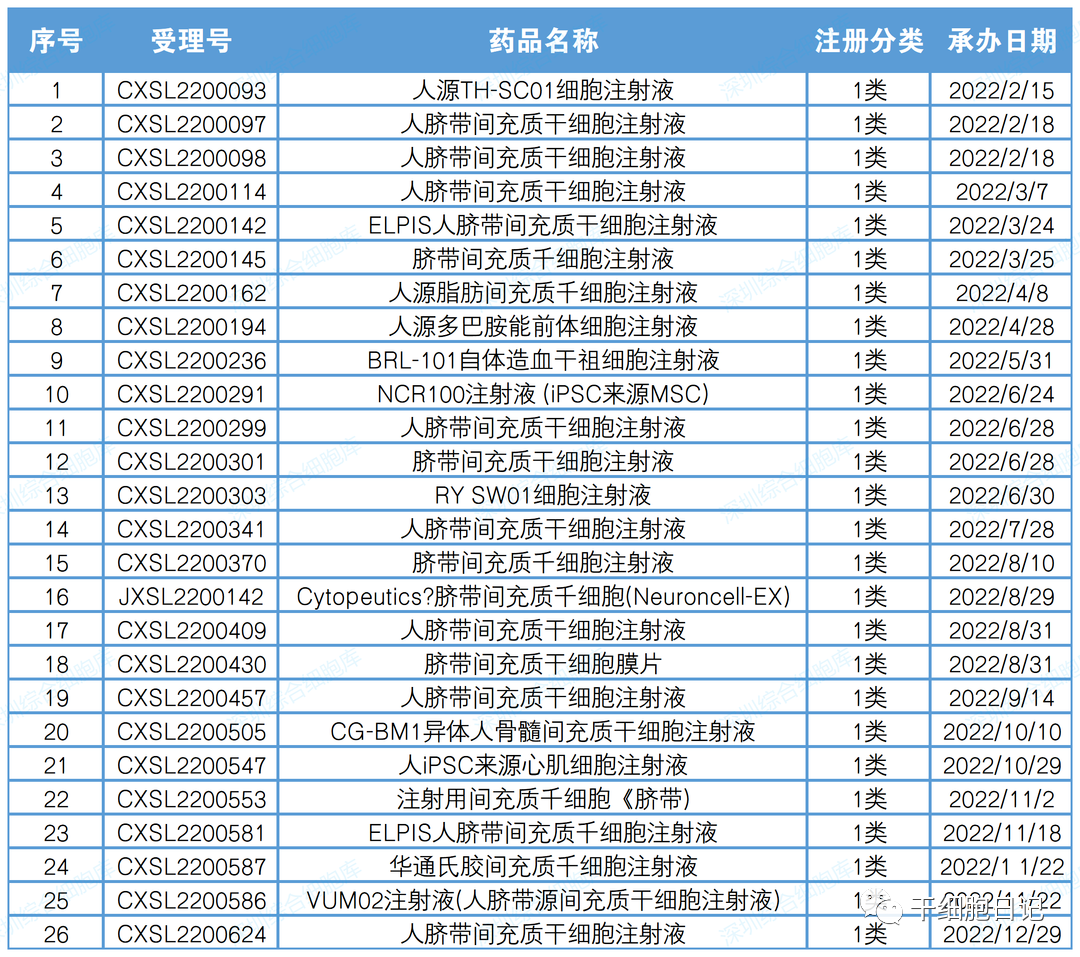
一、2022年CDE干细胞药物临床申请受理26项
其中国产1类创新药注册申请25项,进口1类创新药注册申请1项。进口干细胞药物为Cytopeutics脐带间充质干细胞(Neuroncell-EX)。
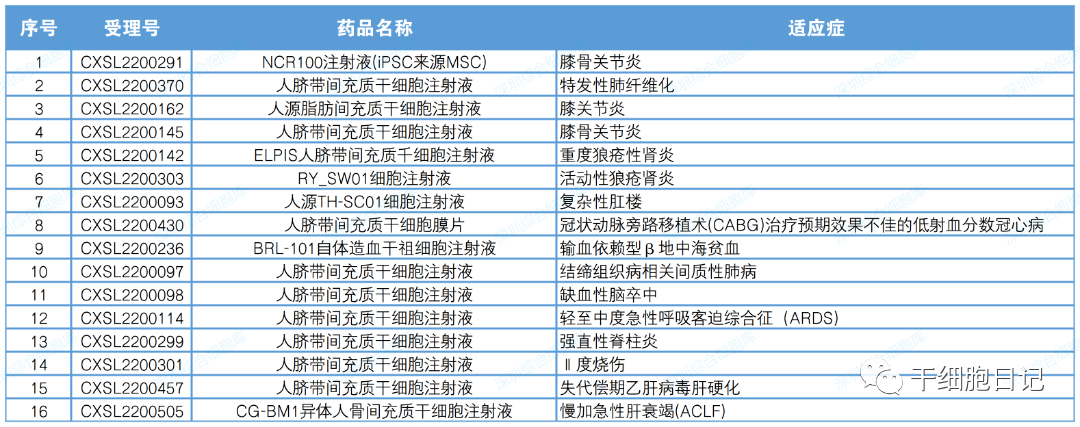
二、2022年CDE临床试验默示许可合计11款干细胞药物的16项临床试验
其中使用间充质干细胞的有11项,间充质干细胞使用类型占比达到68%。
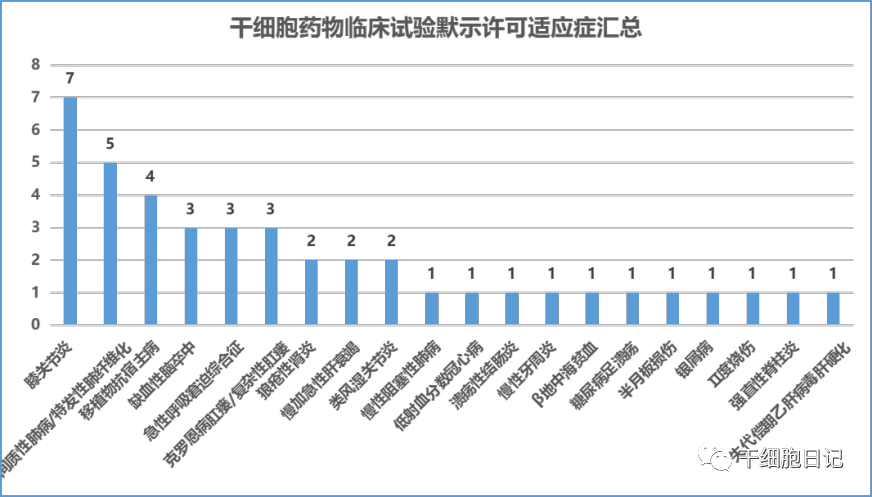
三、临床试验适应证分析申报的干细胞类型分析
截至2022年12月31日,CDE合计默许的42项临床试验涉及20项适应证。其中位于前三的分别是:膝关节炎(7项)、间质性肺病(主要是特发性肺纤维化)(5项)、移植物抗宿主病(GVHD)(4项)。其中膝骨关节炎的7款干细胞药物,干细胞类型包括:自体脂肪间充质干细胞(1种)、异体脂肪间充质干细胞(2种)、脐带间充质干细胞(3种)、人诱导多能干细胞来源的间充质样细胞(1种)。从适应证来看,绝大多数药物利用间充质干细胞的免疫调控能力以针对炎症相关或自身免疫系统相关等疾病展开治疗。
新年伊始,万象更新。相信2023年度会是干细胞药物研发的爆发期,会有更多针对新适应证的干细胞药物进入临床试验阶段。同时,正在开展干细胞药物Ⅰ期/Ⅱ期临床试验也将逐步产生结果,相信随着干细胞技术研发的不断深入,干细胞作为治疗药物离上市将在不远的未来。
图文来源网络免责声明:所载文章版权归原作者所有。转载文章旨在知识分享,如涉及作品内容、版权和其它问题,请联系我们删除!



